Amoniac – một loại hóa chất phổ biến trong tự nhiên, được dùng trong công nghiệp lạnh và công nghiệp chế biến. Vậy bạn hiểu amoniac là gì? Tính chất? Cách điều chế và ứng dụng của amoniac là gì? Mời bạn đọc cùng với chúng tôi tìm hiểu chi tiết về hợp chất này nhé!
Amoniac là gì?
Amoniac chính là hợp chất của Nito (N) và Hydro (H), có công thức hóa học là NH3. Đây là một hợp chất vô cơ, được cấu tạo từ 3 nguyên tử Nito và 1 nguyên tử Hydro để tạo thành một liên kết kém bền vững.
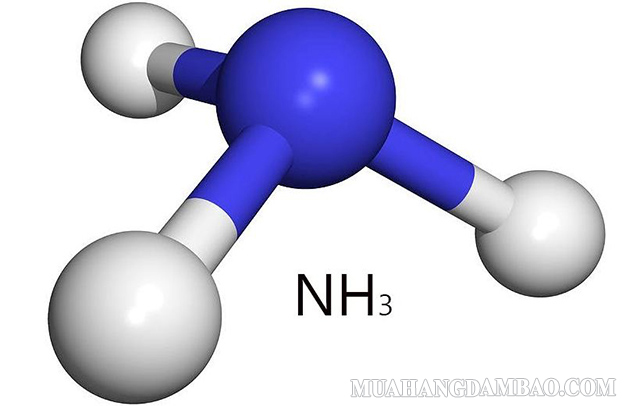
Cấu tạo phân tử của NH3 là dạng hình chóp với nguyên tử Nito ở đỉnh và liên kết cộng hóa trị với 3 nguyên tử Hydro ở đáy của tam giác (3 liên kết N – H ở đây đều là liên kết cộng hóa trị có phân cực, trong đó N có điện tích âm còn H có điện tích dương).
Thực tế thì NH3 được sinh ra rất nhiều trong tự nhiên. Ví dụ như:
- Thận của con người cũng sản sinh ra một lượng nhỏ khí NH3. Đó là lý do vì sao mà nước tiểu sẽ có mùi khai đặc trưng gần giống với khí amoniac NH3.
- Khí NH3 được hình thành bởi các sinh vật có trong tự nhiên thông qua quá trình phân hủy xác động vật dưới sự tác động của các vi sinh vật.
Tính chất của amoniac là gì?
Tính chất vật lý
Khí amoniac có mùi đặc trưng đó là mùi khai. Một lượng nhỏ khí NH3 trong tự nhiên được sinh ra ở thận của con người nên nước tiểu thường sẽ có mùi khai đặc trưng của khí amoniac. Tuy nhiên nồng độ amoniac lớn thì có khả năng gây chết người.
Bên cạnh đó, NH3 còn tan khá nhiều trong nước. Nguyên nhân của hiện tượng này là bởi hidro dễ hình thành liên kết với nước.
Chất khí amoniac có tính chất dễ hóa lỏng và có độ phân từ khá lớn chính bởi liên kết N – H có tính phân cực lớn. Do đó, đây cũng là dung môi hòa tan của nhiều chất. Khi tác dụng cùng với kim loại kiềm và các kim loại Ca, Sr và Ba sẽ hòa tan NH3 lỏng để tạo ra dung dịch có màu xanh thẫm.
Tính chất hóa học
NH3 có tính bazơ yếu
Dung dịch amoniac làm cho quỳ tím chuyển màu xanh và dung dịch phenolphtalein chuyển màu hồng. Điều này minh chứng cho việc amoniac có tính bazo. Nguyên nhân xảy ra vấn đề này là do cặp electron chưa tham gia liên kết ở nguyên tử Nitơ.
Tính bazơ của amoniac yếu hơn so với NaOH và mạnh hơn so với Mg(OH)2. Xếp theo thứ tự giảm dần tính bazo thì ta có: Ba(OH)2 → NaOH → NH3 → Mg(OH)2 → Al(OH)3.
- Amoniac phản ứng với nước để tạo ra được OH-. Chính OH- đã làm xanh quỳ tím và làm hồng phenolphtalein. Ví dụ: NH3 + H2O ⇔ NH4+ + OH-
- Amoniac phản ứng với acid để tạo ra được muối amoni. Ví dụ: NH3 (khí) + HCl (khí) → NH4Cl (khói trắng)
- Amoniac tác dụng với dung dịch muối của các kim loại mà hidroxit không tan thì sẽ tạo ra bazo và muối. Ví dụ: NH3 + Muối (dung dịch) → Bazơ + Muối mới.
Lưu ý: Khi amoniac phản ứng được với muối của Cu2+, Ag+ và Zn2+ sẽ tạo ra kết tủa nhưng sau đó kết tủa cũng sẽ tan do quá trình tạo phức chất tan.
NH3 có tính khử mạnh
Do nguyên tử Nitơ có trong phân tử NH3 có mức oxi hóa thấp nhất -3 nên NH3 cũng có tính khử mạnh. Do đó, amoniac có khả năng tác dụng với O2, Cl2 và oxit của kim loại.
Ví dụ:
- 4NH3 + 3O2 → 2N2↑ + 6H2O (dưới tác dụng của nhiệt độ)
- 8NH3 + 3Cl2 → N2↑ + 6NH4Cl
- 3CuO + 2NH3 → Cu + 3H2O + N2↑ (dưới tác dụng của nhiệt độ)
Như vậy, ta có thể thấy rằng khí NH3 kém bền với nhiệt và chúng rất dễ bị phân hủy khi ở nhiệt độ cao.
NH3 có khả năng tạo phức
Các dung dịch phức chất mà được tạo ra bởi quá trình dung dịch amoniac thì sẽ có khả năng hòa tan hiđroxit hoặc là muối ít tan của một số kim loại.
Sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử Nitơ cùng với ion kim loại tạo nên sự tạo thành các ion phức.
Ví dụ: Khi amoniac tác dụng cùng với Cu(OH)2 thì sẽ tạo ra phức màu xanh thẫm. Cụ thể: Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
Cách điều chế dung dịch amoniac là gì?
Trong phòng thí nghiệm
Dưới điều kiện của phòng thí nghiệm thì NH3 thường được điều chế nhờ vào quá trình tương tác của muối amoni và kiềm hoặc là nhờ vào sự phân hủy của các hợp chất nitơ.
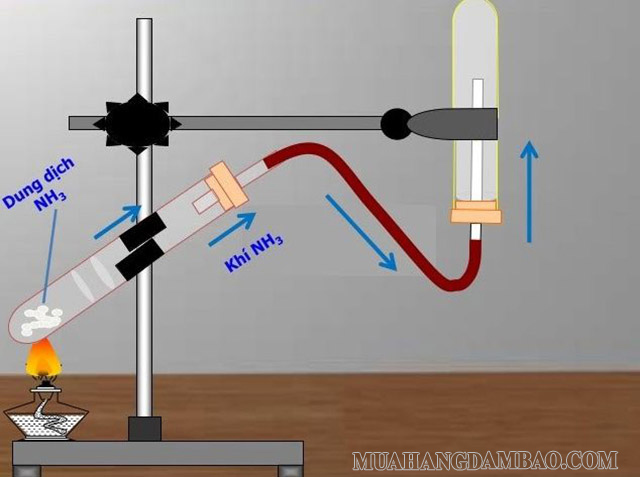
Sự tương tác của dung dịch amoniac đặc cùng với Ca(OH)2 đặc chính là phương pháp điều chế NH3 nhanh nhất trong phòng các thí nghiệm.
Ví dụ: 2NH4Cl + Ca(OH)2 → NH3 + CaCl2 + H2O
Trong công nghiệp
Phương pháp phổ biến nhất để điều chế khí NH3 trong công nghiệp đó chính là sử dụng phương pháp Haber. Cụ thể là thông qua quá trình kết hợp trực tiếp của N2 và H2 dưới điều kiện nhiệt độ cao, áp suất lớn cùng với đó là sự hỗ trợ của chất xúc tác.
Cụ thể, phương trình hóa học là: N2 + 3H2 ⇌ 2NH3
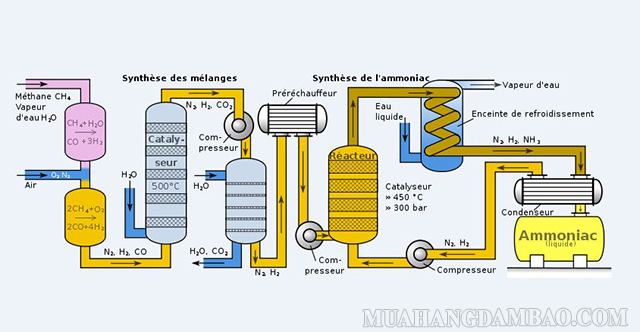
Ngoài phương pháp trên thì chúng ta có thể sử dụng khí tự nhiên để điều chế ra amoniac. Khí tự nhiên sau khi được khử lưu huỳnh thì sẽ thông qua chuyển đổi thứ cấp. Sau khi thông qua các quá trình chuyển đổi CO, loại bỏ CO2… thì chúng ta sẽ thu được hỗn hợp khí nito – hidro. Hỗn hợp này vẫn sẽ chứa khoảng 0.1 – 0.3% CO và CO2.
Sau khi thông qua quá trình tinh sạch thì chúng ta sẽ thu được khí tinh khiết với tỉ lệ số mol Hidro: Nitơ đó là 3 : 1. Tiếp đến chúng ta sẽ được đưa vào máy nén, gắn thêm mạch vòng tổng hợp amoniac để thu được sản phẩm cuối cùng đó là NH3.
Ứng dụng của amoniac là gì?
Ứng dụng của amoniac rất rộng rãi trong đời sống hay trong công nghiệp. Dưới đây là một vài ví dụ điển hình về ứng dụng của NH3:

- Sử dụng làm phân bón: Vì các hợp chất nitơ đều có nguồn gốc từ NH3 nên rất cần thiết cho sự phát triển của cây trồng. Do đó trên thực tế có khoảng 83% NH3 lỏng được sử dụng để làm phân bón.
- Trong nhiều gia đình thì amoniac dạng dung dịch còn được dùng để làm chất tẩy rửa cho các bề mặt như: lò nướng, các đồ thủy tinh, đồ sứ hay thép không gỉ… bởi NH3 lỏng sẽ tạo ra ánh sáng rực rỡ.
- NH3 là chất khử mạnh nên nó còn được sử dụng làm chất chống khuẩn trong thực phẩm với mục đích thương mại. Ví dụ: loại bỏ nhiễm khuẩn trong thịt bò, điều chỉnh độ chua…
- NH3 được dùng để khai thác kim loại như niken và molypden từ các loại quặng. Ngoài ra còn dùng để trung hòa axit, thành phần của dầu thô cũng như bảo vệ các thiết bị tránh bị ăn mòn.
- NH3 được dùng trong xử lý môi trường với mục đích là loại bỏ các chất như sox, nox có trong khí thải, khí đốt nguyên liệu hóa thạch (đá, than…).
Có thể bạn quan tâm:
Amoniac hiện được ứng dụng rộng rãi trong cuộc sống của chúng ta. Tuy nhiên amoniac là một dung dịch độc hại và nó có thể gây hại trực tiếp với con người nếu ở nồng độ cao.